Par Marianne Berdugo, docteur vétérinaire, docteur en sciences médicales, Centre de Recherche des Cordeliers
La prévalence du diabète dans le monde – c’est-à-dire le nombre total de cas à un moment donné — augmente constamment. On pense qu’elle pourrait atteindre 7,7% de la population d’ici 2030, et 12% de la population dans les grandes villes américaines.
Après 10 ans d’évolution de leur diabète, 50% des personnes atteintes de Diabète de type 1 et 30% des personnes atteintes de Diabète de type II, développent des complications oculaires appelées « Rétinopathie diabétique ». Ces complications atteignent la rétine qui est la fine membrane qui tapisse le fond de l’œil et qui nous permet de voir. Lorsque ces complications se produisent, l’acuité visuelle des personnes peut se dégrader, et ce, par 2 mécanismes principaux : la formation d’œdème (qui est un gonflement d’eau) au centre de la rétine, appelé « œdème maculaire », et la mort ou dégénérescence des « neurones » rétiniens, les photorécepteurs.
A l’heure actuelle, le traitement de ces complications oculaires consiste à injecter de façon répétée, directement dans l’œil, une solution soit d’anticorps spécifiques, soit de corticostéroïdes. Ce sont des traitements qui ciblent l’inflammation, l’œdème, les perturbations des vaisseaux sanguins rétiniens ; mais qui n’empêchent pas la mort des neurones de la rétine ni la perte de vision associée. La protection de ces neurones reste donc un enjeu majeur de la recherche sur les maladies oculaires.
Le glibenclamide est une molécule anti-diabétique connue appartenant à la classe des Sulfamides hypoglycémiants (médicaments qui font baisser le taux de sucre dans le sang). Faisant suite à des recherches américaines chez l’animal, l’équipe du Pr Polak de l’Hôpital Universitaire Necker-Enfants Malades, à Paris, a récemment montré que l’administration de glibenclamide était capable, non seulement de traiter l’hyperglycémie (trop de sucre dans le sang), mais aussi de réduire les atteintes neuro-développementales (manque de tonus musculaire, troubles d’acquisition de la coordination et de la planification des mouvements, difficultés d’apprentissage, altérations de la communication entre le cerveau et le corps) chez des enfants ou nourrissons atteints d’une forme de diabète associée à ces troubles ; cela, en protégeant les neurones de leur cerveau.
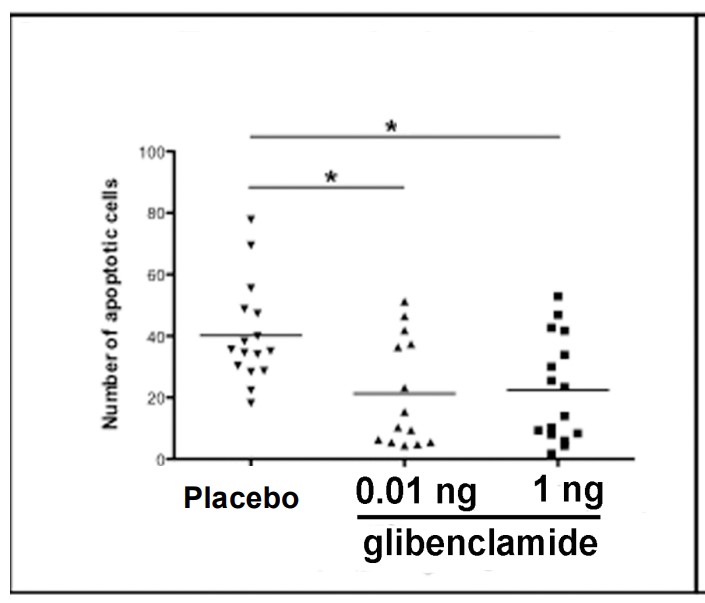
Or, les neurones de la rétine de l’œil sont très ressemblants aux neurones du cerveau. Notre équipe, dirigée par Pr Behar-Cohen au Centre de Recherche des Cordeliers à Paris, vient de montrer, pour la première fois au monde, que l’administration de glibenclamide à des animaux diabétiques protège la structure et la fonction de leur rétine, réduit le nombre de cellules rétiniennes qui meurent (Figure 1), retardant et diminuant ainsi les altérations de leur vision.
Nombre de cellules de la rétine qui meurent
Chez les bébés prématurés, dont le pancréas est immature, il n’est pas rare que se produise une hyperglycémie transitoire. Or, même passagère, cette hyperglycémie peut entraîner des altérations majeures de leur rétine, nécessitant chez certains d’entre eux une intervention chirurgicale oculaire à quelques semaines de vie. Ces altérations peuvent compromettre leur vision jusqu’à l’âge adulte.
Dans la suite du travail précédent, notre équipe a montré que l’administration orale de glibenclamide à des ratons nouveaux-nés qui ont trop de sucre dans le sang, protège les neurones de leur rétine qui sont alors moins nombreux à mourir (Figure 2)
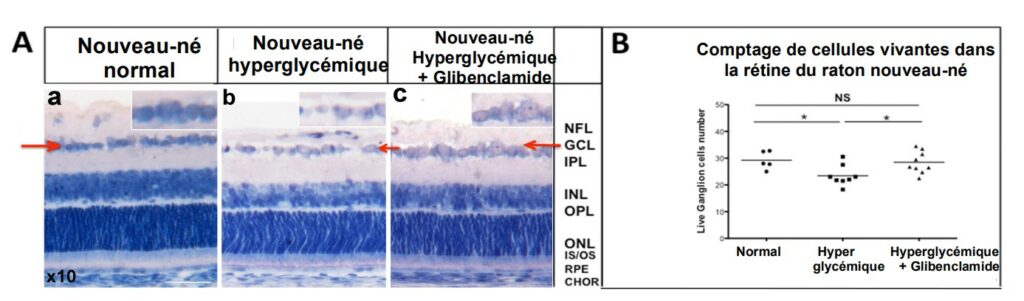
Nous avons également montré que l’œil des Rongeurs (adultes et nouveaux-nés), du singe et de l’homme, contient en grande quantité des récepteurs qui permettent au glibenclamide d’agir localement (Figure 3), même à de très faibles doses — doses qui ne suffiraient pas pour faire baisser la glycémie. Le glibenclamide agit donc par des mécanismes autres que par la Nombre de cellules de la rétine qui meurent Placebo Nouveau-né hyperglycémique Nouveau-né normal Nouveau-né Hyperglycémique + Glibenclamide Comptage de cellules vivantes dans la rétine du raton nouveau-né Normal Hyper Hyperglycémique glycémique + Glibenclamide normalisation de la glycémie. Pour comprendre comment il agit pour protéger les neurones, nous avons mis en évidence de nombreuses voies d’action potentielles. Elles passent par une diminution du stress oxydant, des modifications de l’inflammation, un blocage de certaines voies conduisant à la mort cellulaire dans la rétine ; enfin, la production de facteurs connus pour protéger les neurones.
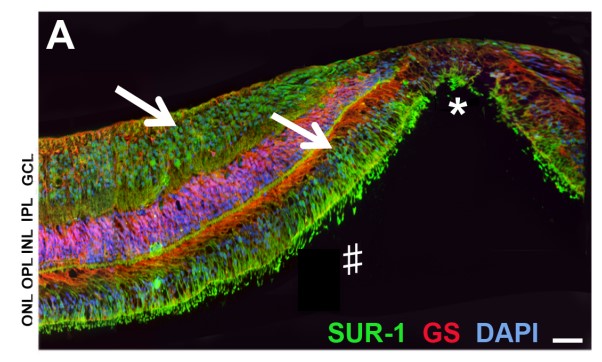
Le glibenclamide, qui est utilisé pour traiter l’hyperglycémie chez l’adulte, et depuis peu chez l’enfant, se révèle donc un médicament potentiel de la protection des neurones oculaires qui nous permettent de voir.
Nos travaux chez le Rongeur nous permettent de penser que, probablement, les personnes diabétiques qui prennent du glibenclamide par voie orale, ont un passage de la molécule dans leurs yeux, suffisant pour obtenir cette protection, en plus de l’effet connu sur l’abaissement de leur glycémie.
En revanche, pour les personnes qui n’ont pas d’hyperglycémie, mais qui nécessiteraient une protection locale de leurs neurones, dans la rétine – par exemple les personnes atteintes de glaucome ou de maladies des vaisseaux sanguins rétiniens — il est nécessaire que soit développée une nouvelle formulation oculaire du glibenclamide, qui pourrait être, dans le meilleur des cas, sous la forme gouttes à mettre sur les yeux, mais plus probablement, sous la forme d’une nouvelle solution injectable dans l’œil. C’est ce sur quoi nous travaillons à présent.
En résumé, le glibenclamide, molécule connue et utilisée dans le diabète, pourrait dans le futur être employé comme « neuroprotecteur rétinien », c’est-à-dire un médicament qui retarderait la mort des cellules de notre rétine dans diverses maladies oculaires, sauvegardant ainsi plus longtemps nos capacités visuelles.
